作者 | 靓靓
编辑 | 小静子
版权所有,请勿转载
荧光定量PCR,相信是各位做分子的同僚们都很熟悉的一个检测手段,通过在反应体系中加入荧光分子,通过荧光信号的按比例增加来反应DNA量的增加,使PCR产物的实时检测成为可能。
由于实时定量建立在模板的初始浓度与CT关系的基础上,因此荧光定量PCR的优化非常重要,保证样本具有准确可重复的实验结果。优化的qPCR结果有以下特点:
1.线性的标准曲线R2>0.980
2.高扩增效率90-105%
3.一致的重复反应 STD<0.5
一种最有效的用来确定qPCR实验是否最优化的方法:将模板稀释成一系列浓度梯度进行PCR反应,用该结果做标准曲线。模板可以用已知浓度的样本(如纳克级的基因组DNA或多拷贝数的单克隆质粒),也可以用未知浓度的样品(如cDNA)。用模板的初始量(或未知浓度样品的稀释倍数)的log值对每个稀释样品的CT值作图,两者呈递减的线性关系,此时就得到了标准曲线。
理论上,一系列稀释样品的扩增曲线之间有均匀的间距,
如下图所示(ABI stepone):
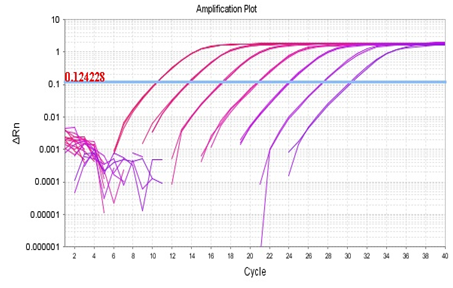
如果产物在每一循环都加倍,荧光曲线之间的间距由等式“2^n=稀释倍数”决定,这里n是CT值之间的间距。按理想情况来看,10倍稀释的样品,2^n=10,因此,n=3.32;将上图中每个稀释样品的CT值与初始模板量的拷贝数值做标准曲线,
结果如下图:

图中显示了斜率Slope为-3.37,R2值为0.999,扩增效率为98.2%(扩增效率的计算公式为E=(10^(-1/Slope)-1)%。
扩增效率接近100%是优化实验好的最佳标志,实际操作时,扩增效率最好可以在90%-105%之间,如果扩增效率不理想,一般有以下几种原因:

接下来为大家介绍几个优化PCR的方法:
首先,当之无愧的当然是退火温度的梯度优化,寻找最佳退火温度;
增加引物浓度,在反应体系中补加甜菜碱、DMSO等辅助因子;如果是模板存放时间过久,可能存在降解的情况,建议重新制备模板;检查仪器,卤素灯是否老化,PCR仪热槽是否被荧光物质污染;
以上几种办法呢,就是小编总结下来,比较常用的优化办法了,其中小编想着重讲一下的,是稀释buffer这个小法宝。
遥想几个月之前,小编遇到了qPCR生涯中的一个超级大瓶颈!!

有那么几个样本,它的扩增效率是这样子的:
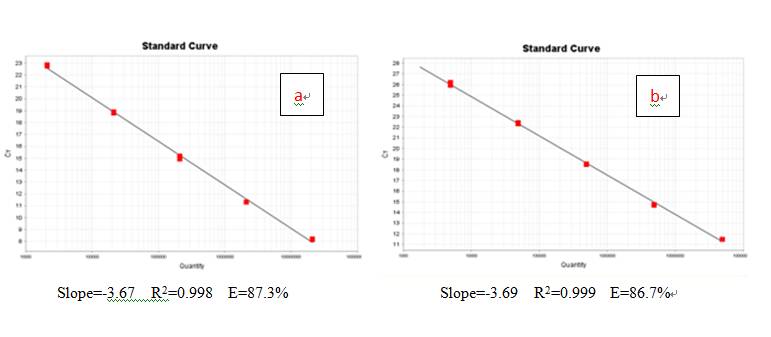
虽然R2值很好,但是扩增效率都低于90%,蓝瘦!香菇!!
于是小编开始了漫漫优化之路,
尝试了降低退火温度,不行!
三步法PCR,不行!!
增加延长时间,不行!!!
尝试了优化反应体系,增加引物浓度,不行!!!!
尝试了重新制备模板,还是不行不行不行!!!!!
最后不得不面对现实,我知道常规手段不足以应对这种情况,看来得换个思路用尽生平所学了!!我随后买来了两个公司的DNA稀释液(A和B),并同时自配稀释液(TK)再实验。
果真是苍天不负有心人
转角才能见男神啊~!
以下是使用三种稀释液以及NF-H2O对同一模板进行稀释后得到的标曲:
NF-H2O
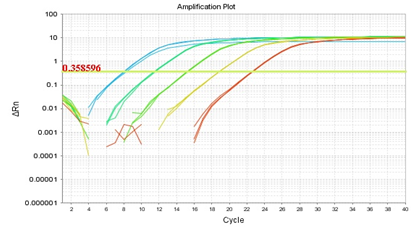

(标准曲线:y = -3.64㏒x +40.22 R2=1 E=88.3%)
A公司

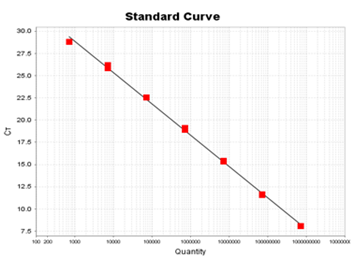
(标准曲线:y = -3.53 ㏒x +39.45 R2=0.998 E=92.1%)
B公司
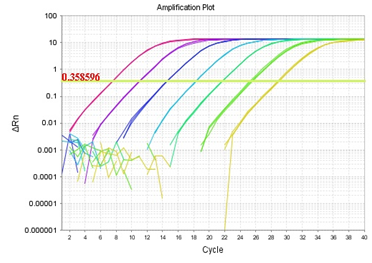

(标准曲线:y = -3.57 ㏒x +39.17 R2=1 E=90.5%)
天科(TK)
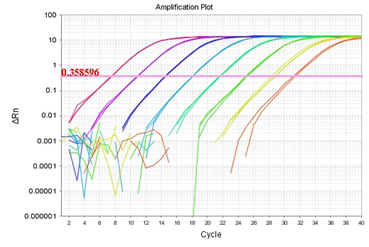

(标准曲线:y = -3.48 ㏒x +38.39 R2=0.999 E=94.0%)
这回结果就相当令人满意了~
可以看出用专门的稀释剂对模板进行稀释的效果普遍优于用NF-H2O稀释的结果,但是哪一家是最优结果呢?小编自配的TK可以说是当之无愧啦,E值以及R2值都很优秀,最重要的一点是,小编总共将模板稀释了8个梯度,其他两家公司得到的有效点只有七个,TK得到了八个点的有效数据,从今以后都用这来做各位上帝的样本哟,请各位放心的送样吧!
以上就是小编对qPCR实验优化的一点小的心得,希望对各位看官老爷有所帮助;要是您在做PCR时遇到问题,用了以上几点方法,或者尝试了更多其他方法,都不能解决的话,请试试更换引物好吗?请看我这真诚的大眼睛(・(ェ)・) ,有时候扩增效率低是引物本身不好造成的,与其再花大量的精力与时间在优化上,重新设计引物,可能是更好的选择哟!